上海恒远生物报道:来自第三军医大学全军免疫学研究所等处的研究人员发表了题为“VSIG4 inhibits proinflammatory macrophage activation byreprogramming mitochondrial pyruvate metabolism”的文章,首次阐明VSIG4可通过调控葡萄糖在细胞线粒体中的氧化磷酸化,从而抑制巨噬细胞M1极化并改善炎症疾病的进展,为抗炎治疗提供了新的靶点。
巨噬细胞是天然免疫屏障的重要组成细胞,不同环境刺激可诱导其不同的表型分化。已有研究表明,炎症如LPS/TNF-α等可刺激巨噬细胞向促炎的M1表型极化,而在IFN-γ或IL-4的诱导下,巨噬细胞则向抑炎的M2型定向分化。促炎的M1型巨噬细胞可加剧肥胖、胰岛素抵抗、关节炎、动脉粥样硬化、肝炎等炎症性疾病病理进程,而抑炎的M2型巨噬细胞则可减轻炎症并促进组织再生。但是对巨噬细胞M1/M2极化的切确机制尚未明确。
也已证实,代谢可调节巨噬细胞的M1/M2极化及其效应。比如,M1型巨噬细胞的极化及效应功能的发挥依赖于葡萄糖的糖酵解提供能量;而M2巨噬细胞的存活及活化则主要依赖于脂肪酸的氧化及谷氨酰胺在线粒体内的代谢即氧化磷酸化(OXPHOS)提供能量。可是,作为重要的细胞能量提供者,葡萄糖如何影响巨噬细胞M1/M2极化尚未清楚。胞外的葡萄糖结合细胞表面的葡萄糖受体后被摄取进入细胞内。在一系列催化酶的作用下葡萄糖转化成丙酮酸,而丙酮酸在丙酮酸脱氢酶(PDH)的进一步催化下产生乙酰辅酶-A(Acetyl-CoA),乙酰辅酶-A进入线粒体内经历三羧酸循环氧化磷酸化后,产生诸如活性氧(ROS)、电子并提供细胞活动的能量物质如ATP等。然而,这一过程是否影响巨噬细胞的M1/M2极化及其效应功能尚为未知。
本研究作者发现巨噬细胞表面表达的一个膜受体分子VSIG4(V-set immunoglobulin-domain-containing 4)可抑制巨噬细胞的M1极化及其活化。研究表明来源于Vsig4基因敲除小鼠(VSIG4 KO)的巨噬细胞在LPS的刺激下呈现M1表型,既分泌更多的炎症因子、上调细胞活化标志物等。而过表达Vsig4能够抑制LPS诱导的巨噬细胞的活化。分子机制研究发现VSIG4通过激活PI3K/Akt-STAT3通路,促进了丙酮酸脱氢酶激酶-2(PDK2)的活性,而激活的PDK2可抑制葡萄糖氧化磷酸化过程中关键节点-丙酮酸/乙酰辅酶-A的转换,从而降低了进入线粒体内乙酰辅酶-A的水平,*终减少线粒体活性氧(mtROS)等细胞活性物质的产生及M1极化。进一步在高脂(HFD)诱导的肥胖模型和小鼠感染病毒-3型(MHV-3)感染诱发的暴发性肝炎模型中均发现,VSIG4 KO小鼠较野生型WT小鼠有更多的炎症累积。从而导致VSIG4 KO小鼠更易肥胖和胰岛素抵抗加重。于此同时,MHV-3病毒感染后VSIG4 KO小鼠较野生型小鼠死亡率更高,肝组织损伤更重。可是,肝脏过表达VSIG4则可下调炎症,并改善MHV-3病毒感染诱导的肝脏弥漫性凝血及肝坏死等病理损伤。
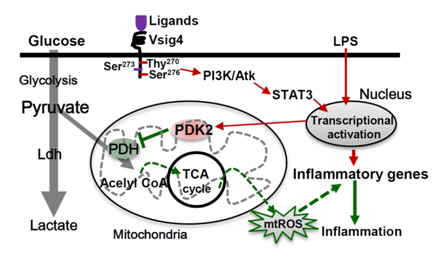
VSIG4激活PDK2调节代谢并抑制巨噬细胞M1极化的分子机制
这项工作得到了国家自然科学基金委(NSFC-优秀青年科学基金(No. 81222023)、NSFC-NIH海外合作基金(No.81361120400)及国家重点研发专项“蛋白质机器与生命过程调控”(No.2016YFA0502204)的资助。上海恒远生物对这一重要研究发现表示热烈的祝贺。为了助力更多科研朋友的工作,本公司将持续为科研单位提供更优质更放心的科研产品!
